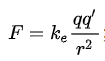|
分子间作用力分子间作用力,顾名思义其实就是分子之间产生的相互作用力 在高中还是初中,我们应该学过这个东西,就是分子间作用力=斥力+引力的矢量和
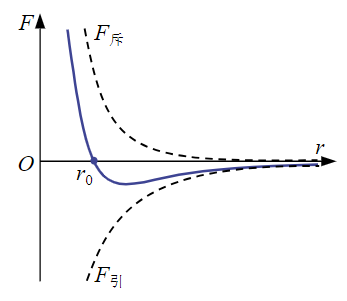
从这个图我们知道随着距离r增加,引力与斥力都会减小,我们可以知道在r0的时候斥力与引力相等 其实从这个图我们可以看到引力与斥力的变化其实不一样的 在小于r0的时候,分子间作用力以斥力为主 在大于r0的时候,分子间作用力以引力为主 但是随着r不断增大又会趋近于0 根据维基百科的说法 分子间作用力(英语:Intermolecular force),亦称分子间引力,指存在于分子与分子之间或高分子化合物分子内官能团之间的作用力,简称分子间力。它主要包括: 范德华力(Van der Waals force):起初为了修正范德华方程而提出。普遍存在于固、液、气态任何微粒之间,与距离六次方成反比。根据来源不同又可分为:
次级键(Secondary bond):键长长于共价键、离子键、金属键,但短于范德华相互作用的微观粒子相互作用。
此外科学家也不断研究新的分子间作用力,包括双氢键和金键等。 分子间作用力 - 维基百科,自由的百科全书 (wikipedia.org) 因此很多人认为分子间作用力是以范德华力为主 但是大家在做MD的时候我们会发现,我们其实认为的是范德华力与静电相互作用力为主 出现这个理解偏差的原因是 我们在初中高中,我们精确的将带电粒子认为是离子,不带电荷的是分子 所以认为分子就不存在电荷,怎么可能会有静电相互作用力呢 这种理解,那么MD的molecule dynamic应该怎么写? 叫分子/离子/原子动力学? 我们在做MD的时候会把这些统计进去的 所以如果存在离子是不是就有电荷了,是不是就满足库伦作用?
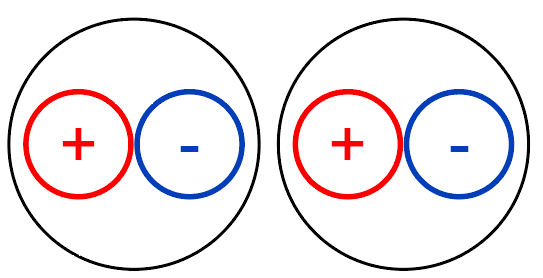
那么是不是就存在库仑力了 哪有人又要抬扛了,如果都是分子,那么是不是没有库仑力了? 那你有没有相关极性这个词是什么意思? 高中应该学过的什么叫做极性分子,非极性分子 如果正负电荷中心不重叠是不是就会产生极性
假设大黑球是一个分子,由于前面说的极性问题 那你现在分析的时候考虑一下正负中心的静电相互作用力求解 你自己把距离带入进去比较就知道了,这个就是会存在库伦作用的 这个在MD计算中属于范德华力的偶极-偶极力(核心本质就是静电相互作用力) 只是MD计算时这块是用于范德华力的计算中 那么有人会问斥力与引力的关系是什么
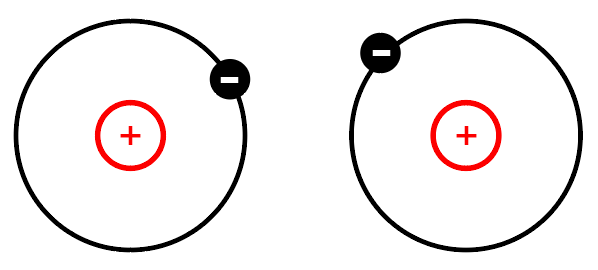
中间的正电荷是原子核,负电荷是电子,这个是基于原子结构模型进行考虑 当两个分子靠近时,是不是存在正负电荷相互吸引的问题,同时异性电荷会相互排斥 这个里面我们说的是相互靠近,其实指的是原子核的靠近 因为原子核的质量远大于电子,电子在受到斥力会进行移动,造成距离上的偏移 所以在移动距离的时候,电子会发生变化 当r>r0时,会呈现引力,当r<r0时,原子核不能移动距离了,所以这个斥力就会更加明显 所以在理解分子间作用力时 不要抬杠来说只有范德华作用,没有库伦作用,或者说只有斥力与引力,不存在静电相互作用 在我们计算MD的时候会引入一个叫作原子电荷的内容 我们在MD计算时是计算原子电荷的库伦作用 所以在MD计算时主要是计算范德华作用+静电相互作用 注意在MD分析分子间作用力时,统计的会把分子1与分子2之间的原子之间的作用全部统计进去 所以经常有人用不同分子数目,原子数目进行比较相互作用说明稳定性的问题,这个你自行看着吹牛吧 |