|
解析乙醇修饰的囊泡溶液中瞬时多层膜形成过程的分子机制时间:2025-07-02
*欢迎大家去观看原文,并引用 标题:Unraveling the Molecular Mechanism of Transient MultilamellarFormation in Ethanol-Modified Vesicle Solutions 期刊:Langmuir 2025, 41, 13372−13380 网址:https://doi.org/10.1021/acs.langmuir.5c01139
一、文章摘要最近的一项基于微流控技术的小角度 X射线散射(SAXS)测量结果令人颇感兴趣,它表明在水溶液中将单层脂质囊泡与乙醇混合的过程中,会暂时形成多层结构。本研究旨在探究这一现象背后的可能分子机制,主要通过粗粒化分子动力学(CG-MD)模拟来进行。我们首先研究了在水溶液中乙醇浓度对脂质聚集形态的影响。尽管在纯水溶液中观察到了囊泡,但随着乙醇浓度的增加,囊泡膜中的孔隙形成变得更加频繁。当乙醇浓度超过52%时,囊泡变得不稳定,并转变为蠕虫状膜状结构。我们假设这种暂时的多层结构可能是由于囊泡之间有效相互作用的差异而形成的囊泡堆叠所致。然而,一系列平均势能力(PMF)计算始终显示,无论乙醇浓度如何,囊泡之间都存在排斥性相互作用,这排除了这一可能性。相比之下,一旦脂质团块转变为蠕虫状的微胶束,它们之间的压力势能屏障就会降低(约5kBT),从而促进融合。我们的 CG-MD模拟进一步表明,在高乙醇浓度下,脂质团块(微胶束)能够轻易地融合并增大。随后在较低的乙醇浓度下,这些增大的团块会重新排列成具有内部层状结构的囊泡——多层囊泡。这些发现表明,在微流控装置中,单层囊泡溶液与乙醇的不均匀混合在瞬时多层结构的形成中起着关键作用。
二、计算图文
表 1.模拟系统。
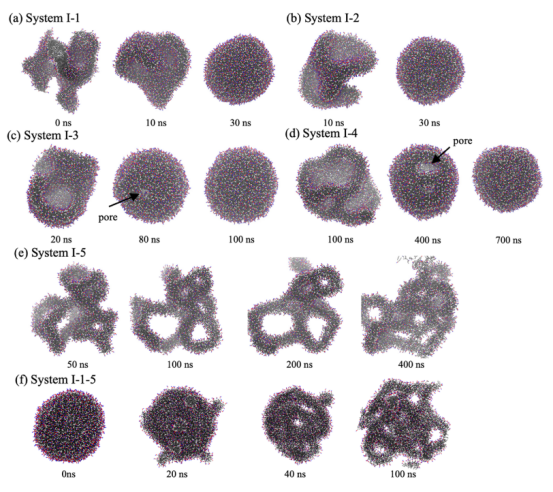
图 1.不同乙醇浓度下乙醇溶液中脂质聚集物的形态变化。用彩色的甘草图形来表示 POPC 分子(蓝色:胆碱;红色:磷酸盐;银色:甘油;白色:酯;灰色:疏水尾部)。
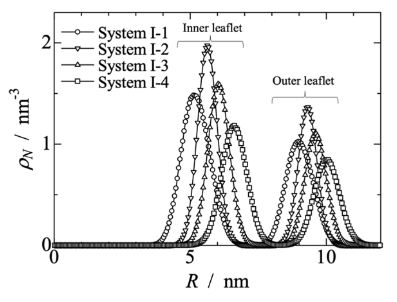
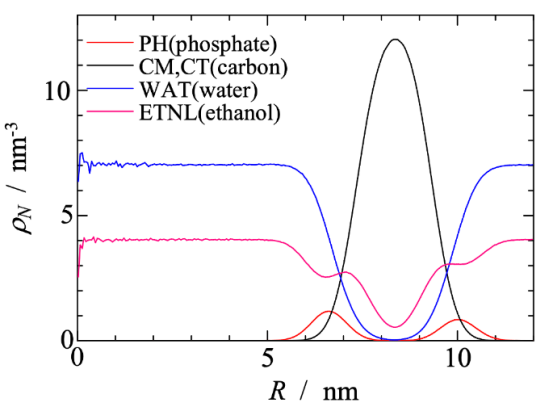
图 2.囊泡质心沿径向轴方向上 PH区段的概率(数量密度)分布。
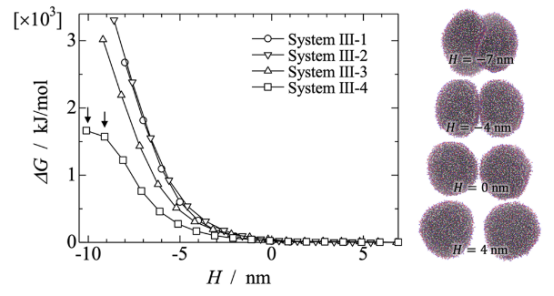
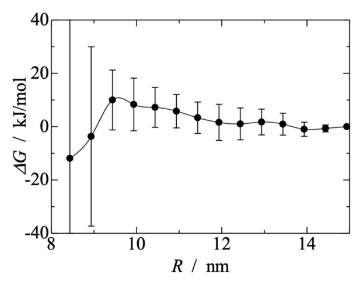
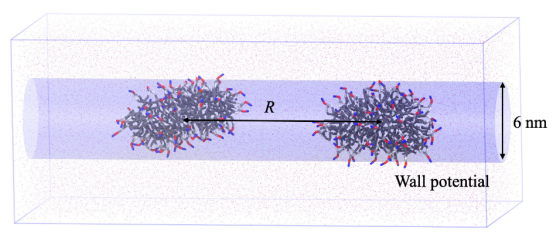
图 3.(左面板)通过使用受约束分子动力学模拟进行的热力学积分计算得出的在不同乙醇浓度的水溶液中两个小泡之间的潜在平均力分布。(右面板)从系统 III-1 中获取的在不同距离下的若干帧图像,H。颜色方案与图1 中的相同。
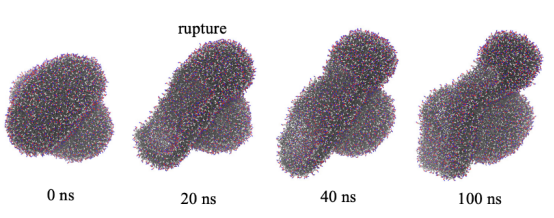
图 4.在系统 III-4 的 MD模拟中,在将 R =10纳米处的距离限制解除后,从闭合状态恢复到破裂状态的封闭囊泡。在初始构型中,由于强烈的距离限制,其中一个囊泡破裂了。在图1所示的相同颜色方案中展示了 POPC 分子。
图5.两个细长胶束相互靠近时其中心对称面之间的概率密度分布图,此时两胶束的长轴处于同一直线上。该图是通过贾尔津斯基等式并结合20次不同的分子动力学模拟得出的。竖条表示第二个累积量(功的离散度),其计算公式为(1/2)β(⟨W2⟩ - ⟨W⟩2)。
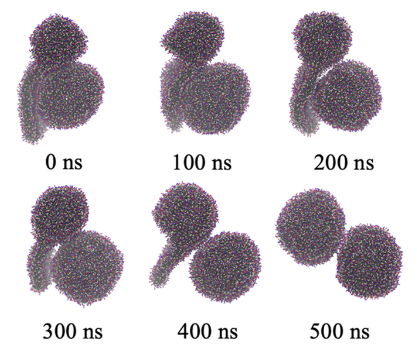
图 6.一系列分子动力学模拟展示了从多个超小液滴中获得微乳液的可能途径。图中的(a)、(b)和(c)分别展示了系统 V-1、V-2 和 V-3 的最终状态。(d)系统 V-4 的初始构型。(e)系统 V-4 中脂质团块的时间演变情况。POPC 分子的描绘采用了与图1相同的色系。图(d)中的透明区域代表水-乙醇溶液。
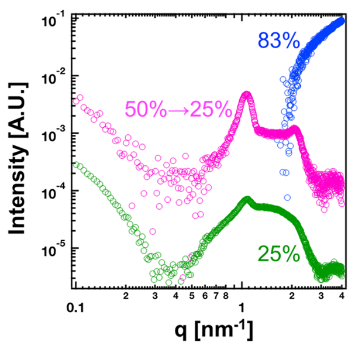
图7.含乙醇的囊泡溶液的小角 X射线散射图谱。绿色:含25%乙醇的囊泡溶液;粉色:乙醇浓度在50%至25%之间的囊泡溶液;蓝色:含83%乙醇的囊泡溶液。
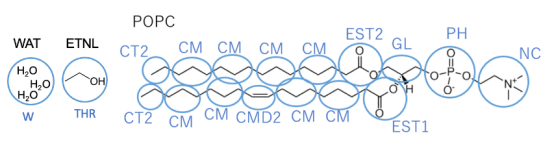
图 S1:SPICA力场中的粗粒化(CG)映射。各段名称以蓝色显示。
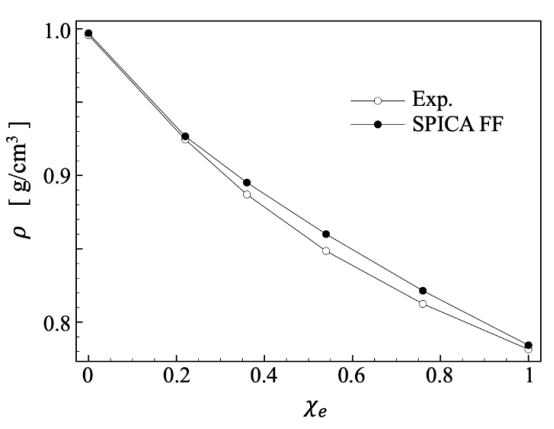
图 S2:在303 K条件下,乙醇溶液密度与乙醇摩尔分数关系的对比图。实验数据来源于参考文献[1]。
图 S3:水溶液中256个 POPC 分子的带状结构。该系统被模拟以计算沿 y轴的线张力。颜色方案如下:NC(蓝色)、PH(红色)、GL(银色)、EST(白色)以及 CM 和 CT(灰色)。水以透明青色的连续体形式呈现。
图 S4:在系统 IV 中,通过在 POPC 的疏水尾部施加引导壁势(由一个透明圆柱体表示)来评估两个伸展型胶束之间的结合自由能曲线。进行了20次引导分子动力学模拟以获得 R 的函数形式的自由能曲线。颜色方案与图 S2相同。
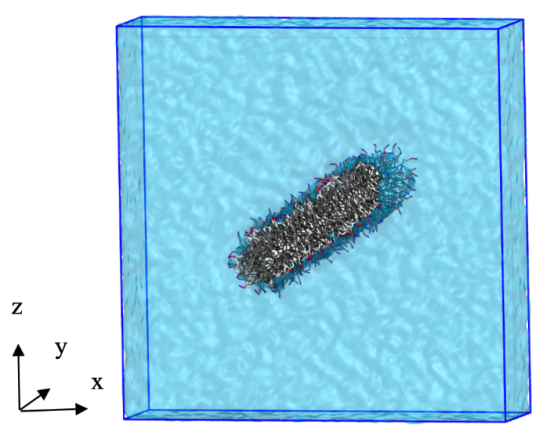
图 S5:在系统 I-4 中,每个 CG粒子类型沿膜泡质心所在径向轴的分布密度图。
图 S6:在系统 III-4 中,当 R =10纳米(H = -10.1纳米)且存在约束条件时,两个囊泡的结构变化。在20纳秒时,其中一个囊泡在与接触区域相对的一侧出现了破裂,并由于距离的限制开始包裹另一个囊泡。两个囊泡之间没有融合(即疏水片段没有连接)。
三、计算分析3.1. 模型校准:利用实验数据优化计算模型关联机制:通过图S2直接比较模拟结果与实验数据,以校准和验证CG-MD模型的准确性。这确保模拟能可靠预测乙醇-水溶液的性质,为基础计算提供实验基准。
关键内容:图S2展示乙醇溶液密度随摩尔分数的变化(303 K),其中模拟数据(CG-MD)与实验数据(来自文献[1])高度吻合。这证明SPICA力场在模拟中能精确再现实验测量的物性参数,为后续脂质膜模拟的可靠性奠定基础。 在文中的“Materials and Methods”部分,作者强调SPICA力场参数已通过实验验证(如界面张力、膜厚度等),确保模拟能真实反映脂质行为。图S2是这一过程的核心支撑。
3.2. 现象解释:计算模拟揭示实验观测的分子机制关联机制:使用CG-MD模拟解释SAXS实验观测到的瞬态多层结构形成。模拟预测乙醇浓度梯度驱动脂质形态转变(如囊泡→蠕虫状胶束→多层囊泡),并通过实验数据验证这一机制。
关键内容:在“Results and Discussion”部分,模拟显示高乙醇浓度(>52%)时,脂质聚集体转变为蠕虫状胶束(图1),其融合能垒低(~8 kJ/mol,图5)。这解释实验中局部乙醇浓度波动导致脂质融合和生长。 实验部分(SAXS测量)显示,当乙醇浓度从50%降至25%时,多层结构显著增强(图7)。模拟(System V系列)重现这一过程:高乙醇浓度下胶束融合,再于低浓度重组为多层囊泡(图6e)。这种计算-实验联动表明,非均匀混合是瞬态多层结构形成的核心机制。 图S5和S6提供补充证据(如径向密度分布和囊泡变形)。 实验验证(图7):SAXS数据直接支持模拟预测的浓度依赖变化。
3.3. 结果验证:实验数据证实计算预测关联机制文中的实验部分(SAXS)作为独立验证工具,直接测试模拟预测的可信度。例如,模拟提出的“乙醇浓度降低导致多层结构形成”假设,被实验数据明确支持。
关键内容:在“Experimental Verification”部分,SAXS测量显示:当乙醇浓度从50%降至25%时,Bragg峰强度显著增强(图7),表明多层结构形成。这与模拟结果(System V-4)高度一致,其中脂质聚体重组为多层囊泡(图6e)。 文中强调,模拟的预测(如线张力降低导致膜不稳定)与实验观测的囊泡破裂和重组现象吻合(图3和SAXS数据),消除了单纯囊泡堆叠假设的误区。 文中未直接涉及实验验证,但通过提供模拟细节(如线张力计算,表2)间接支持主文章的关联框架。
3.4. 整体关联框架总结互补角色:文中聚焦计算模型的校准和细节(如密度、线张力),确保模拟基于实验基准;文中整合计算与实验,用模拟解释机制,用实验验证预测,形成闭环。 增强可信度:通过实验数据(SAXS、密度)校准模型后,模拟能预测未知现象(如瞬态多层形成),实验再证实这些预测,提升研究的科学严谨性。 局限性:关联主要依赖文中的实验部分(SAXS),文中的图片(如S3、S4)虽支持模拟但未直接链接实验;未来可扩展更多实时实验-模拟对照。 这种结构化的计算-实验关联不仅阐明乙醇诱导脂质重组的分子机制,还示范了多尺度研究方法在纳米载药系统设计中的价值。
四、计算方法4.1计算模拟方法粗粒化分子动力学(CG-MD)框架力场模型: 采用 SPICA力场(文档2第2.2节),其参数通过实验数据校准: u 脂质双层界面张力、膜厚度、面积膨胀模量等(文档2参考文献13,19); u 乙醇(ETNL)模型基于氨基酸侧链类似物开发,校准了表面张力、密度及跨膜自由能(文档2第2.2节,文档1图S2验证密度准确性)。
粗粒化映射: 单个CG粒子代表约3个重原子及关联氢原子,映射方案见文档1图S1:
4.2. 关键模拟参数体系设置:温度:303 K(Nose-Hoover或V-rescale控温) 压力:1 atm(Andersen或Parrinello-Rahman控压) 截断半径:1.5 nm(Lennard-Jones相互作用) 长程静电:PPPM(LAMMPS)或PME(GROMACS) 时间步长:10 fs
体系分类与规模(文档2表1): 共设计5类系统(System I-V),涵盖不同脂质(POPC)、水(WAT)、乙醇(ETNL)比例,例如:
System I:2000个POPC分子在不同乙醇浓度下的形态转变(0-52%乙醇); System II:256个POPC的带状膜测量线张力; System III:双囊泡相互作用的PMF计算; System IV:蠕虫状胶束融合的自由能分析; System V:多囊泡在动态乙醇浓度下的重组过程。
4.3. 特殊模拟方法线张力计算(System II): 采用带状膜模型(文档2第2.3节),通过压力张量计算线张力: γ=1/2<Lx><Lz>(1atm−<Pyy>) 初始结构见文档1图S3
自由能计算:PMF(囊泡相互作用):约束距离法(System III),通过热力学积分获得(文档2第2.3节); 胶束融合能垒:引导势结合SMD模拟(System IV),20次重复采样,Jarzynski等式计算(文档2第2.3节,文档1图S4展示引导势):
五、特别说明两篇文章中分别使用LAMMPS和GROMACS软件的原因分析在文中(主文章)的“Materials and Methods”部分,作者明确说明了粗粒化分子动力学(CG-MD)模拟中分别使用LAMMPS和GROMACS软件的原因。这种分工基于系统规模、软件特性和计算效率的优化需求,以下从多个维度详细解析:
5.1. 核心原因:系统规模与计算效率优化主要模拟使用LAMMPS:文中指出,大多数CG-MD模拟(涵盖System I-IV)使用LAMMPS(Large-scale Atomic/Molecular Massively Parallel Simulator),因为它是一个通用、高性能的分子动力学软件,适用于中小规模系统的快速迭代(文中第2.2节)
LAMMPS的优势在于:高效处理并行计算,支持NPT/NVT系综、PPPM长程静电算法等,适用于常规脂质膜和囊泡系统(如System I-III)。 时间步长设置为10 fs,LAMMPS的稳定性和灵活性确保了模拟的可靠性,例如在计算囊泡形态转变(System I)或线张力(System II)时。
大规模系统切换至GROMACS:对于System V(涉及8个囊泡的动态重组,脂质分子数达16,000 POPC),文中明确提到使用GROMACS(GROningen MAchine for Chemical Simulations)版本5.1.4(文中第2.2节)。原因包括: System V是研究中规模最大的系统(见文中表1),需要处理高复杂度动态过程(如乙醇浓度梯度下的脂质融合)。GROMACS在处理大规模生物分子系统时具有更优的并行效率和内存管理,特别适合长时间尺度(如1 μs)的模拟。 GROMACS通过“aromas-spica patch”(一个定制化补丁)支持SPICA力场,确保力场参数与软件兼容性,避免大规模模拟中的数值不稳定问题(文中参考文献30)。
关键引用:“CG-MD simulations mainly were performed using LAMMPS. However, only the CG-MD simulations for the larger system(System V; see later) were carried out using GROMACS ver. 5.1.4 with the aromas-spica patch.”(文中第2.2节)
5.2. 软件特性差异驱动的分工LAMMPS的优势:算法适应性:LAMMPS支持多种约束算法(如距离约束用于System III的囊泡相互作用PMF计算)和热力学积分,适用于快速采样中小系统(文中第2.3节)。 资源消耗:对于System I-IV(脂质分子数≤4,000 POPC),LAMMPS在常规超算设施上运行效率更高,节省计算资源(文中致谢部分提到使用东京大学超级计算机)。
GROMACS的优势:大规模并行性能:GROMACS的优化内核(如PME静电算法和V-rescale控温)在处理System V(高粒子数体系)时显著减少计算时间。文中中System V模拟时长900 ns至1 μs,GROMACS的强扩展性(strong scaling)确保高效完成。 力场兼容性:SPICA力场在GROMACS中通过“aromas-spica patch”实现,该补丁针对脂质-乙醇相互作用优化(文中参考文献30),避免LAMMPS中可能存在的参数转换误差。
实际影响:在System V的模拟中,GROMACS成功捕捉了多囊泡在乙醇浓度波动下的重组过程(文中图6),包括蠕虫状胶束融合和多层囊泡形成,验证了分子机制的可扩展性。 若仅使用LAMMPS,大规模System V的模拟可能面临性能瓶颈或收敛问题。
|