|
锂介导的有序排列双电团簇调控固态电解质界面下的氨电合成反应
*欢迎大家去观看原文,并引用 标题:Lithium-Mediated Ammonia Electrosynthesis over Orderly ArrangedDipoles Regulated Solid-Electrolyte Interphase 期刊:J. Am. Chem. Soc. 网址:https://doi.org/10.1021/jacs.5c00551
一、文章摘要锂介导的电催化氮还原反应(Li-NRR)被认为是一种极具潜力的替代方案,可取代能耗极高的哈伯-博施工艺。然而,由电解液衍生出的固体电解质界面容易阻碍锂离子的扩散和成核过程,从而最终抑制氮的活化以及后续的质子化过程。在此,我们成功在商业的钡钛氧杂化纳米粒子(BTO)表面构建了表面氧空位(Ov),并进一步推动其从立方/四方相转变为菱面体相,这增强了富含氧空位的钡钛氧杂化物(BTOV)的铁电性,并产生了有序排列的偶极子。系统的实验和计算结果证实,氧空位诱导的有序排列的偶极子能够容易地吸附电解液中的阴离子,并促进它们还原形成富含锂氟的电解质界面(SEI)。优化后的阴离子衍生的SEI增强了锂离子的转移动力学,并有效地促进了锂离子的均匀成核,从而降低了锂离子脱溶的能量,并使反应物能够顺利穿过SEI。因此,所制备的 BTOV 的法拉第效率达到93.01%,在 -0.5 V电压下氨气生成速率可达6.94纳摩尔每秒每平方厘米,其性能较 BTO 对应物提高了45倍以上。这项工作为引入有序排列的偶极子来调节 SEI化学以及进一步增强 Li-NRR 的内在活性开辟了新的前景。
二、计算图文
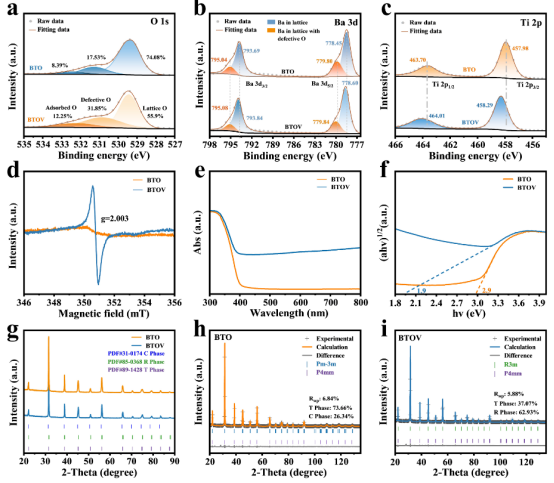
图 1.高分辨率(a)O1s、(b)Ba3d 和(c)Ti2p谱图,分别对应于 BTOV 和 BTO;(d)电子自旋共振(ESR)谱图,(e)紫外-可见-近红外漫反射光谱,以及(f)库贝卡-穆恩转换型漫反射光谱,分别对应于 BTOV 和 BTO;(g)BTOV 和 BTO 的 X射线衍射(XRD)图谱;以及(h)BTO 和(i)BTOV 的 XRD 图谱的里特维尔德精修。
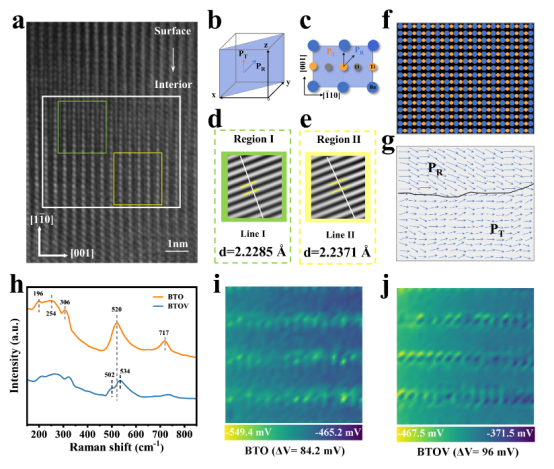
图 2.(a)沿[110]晶向轴的 BTOV 的 HAADF-STEM 图像;(b)BaTiO3单元胞的示意图以及(c)沿[110]晶向轴对应的示意图投影;(d、e)HAADF-STEM 图像中选定区域的 IFFT 图像;(f、g)从 HAADF-STEM 图像中的白色矩形框区域定位的 HAADF-STEM 图像的拟合图像;(h)BTOV 和 BTO 的拉曼光谱;(i)BTO 的 Kelvin探针力显微镜图像以及(j)BTOV 的 Kelvin探针力显微镜图像。
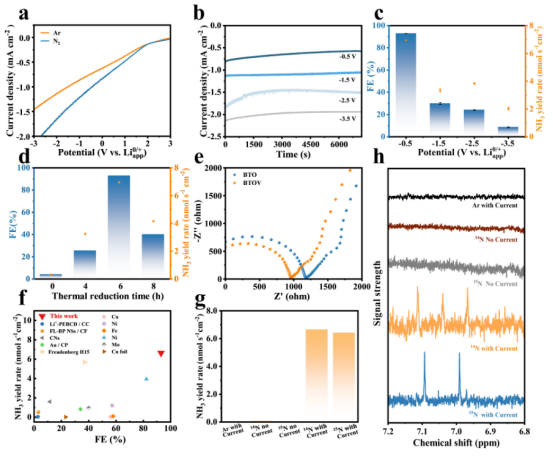
图3. (a)BTOV 在 N2 和 Ar恒定饱和有机电解液(四氢呋喃溶液 +2%体积的乙醇 +0.2摩尔/升 LiBF4)中的 LSV曲线;(b)BTOV电催化剂在不同电位下于有机电解液中进行2小时的 chronoamperometric曲线;(c)BTOV 在不同电位下的 FE 和 NH3生成率;(d)所制备的不同催化剂在 -0.5 V与 Li0/+ app相比下的 FE 和 NH3生成率;(e)BTOV 和 BTO 的 EIS谱图;(f)本研究与先前报道研究的性能比较;(g)BTOV 在不同操作条件下的 NH3生成率以及(h)相应的1H NMR谱图。
图 4.(a)BF4− 在 BTOV 和 BTO 上的计算吸附能;(b)电解液浸润后的 BTOV 和 BTO 的拉曼光谱;(c)(锂离子)解离的活化能以及(d)反应物穿过 SEI 的活化能;(e)在蚀刻实验中 BTOV 和 BTO 在蚀刻过程中的锂氟化物生成百分比;以及(f)在不同蚀刻时间下 BTO 和 BTOV 的高分辨率 F1s光谱。
图 S10 (a)氮气饱和电解质和(b)阿加斯饱和电解质的溶剂化结构模型。
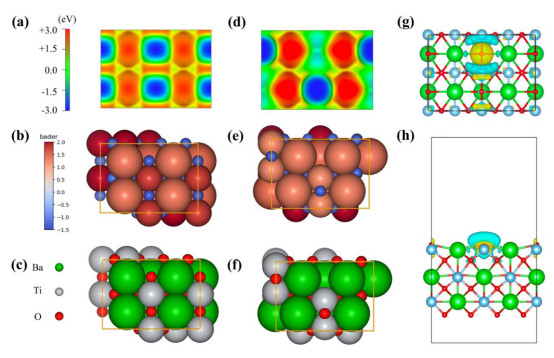
图 S22 BaTiO3[110]表面的静电势能图(a)无氧空位(BTO)和(d)有氧空位(BTOV)。电子密度等值面绘制在0.006 e·bohr-3处。色标表示静电势能的范围。BaTiO3[110]表面的 Bader电荷着色图(b)无氧空位和(e)有氧空位。BaTiO3[110]表面的优化结构(c)无氧空位和(f)有氧空位。(g-h)氧空位形成的电荷密度差,黄色和青色分别表示电子积累和缺失,等值面值为0.002 e/bohr3。
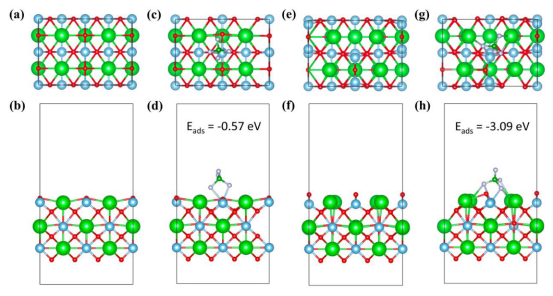
图 S23(a-b):不含氧空位的 BaTiO3[110] 的计算模型;(c-d)BF4- 在 BaTiO3 上的吸附模型及计算的吸附能。(e-f):含氧空位的 BaTiO3[110] 的计算模型;(g-h):BF4- 在 BaTiOV 上的吸附模型及计算的吸附能。
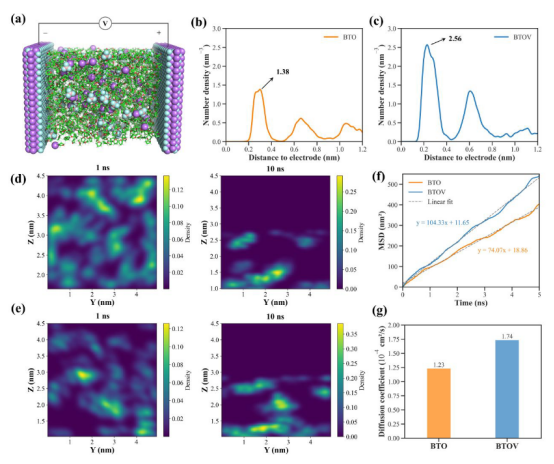
图 S24(a)恒电位分子动力学模拟系统的示意图。电解质由 LiBF4、乙醇和 THF组成,被限制在两个平行的平面 BTOV电极之间。在电极之间施加7伏的电位差,对应于正极的 +3.5伏和负极的 -3.5伏。与电极间距相关的锂离子数量密度分布曲线分别对应于(b)BTO系统和(c)BTOV系统。不同时间段内 BTO 和 BTOV系统中锂离子的空间分布情况(d)和(e)。(f)锂离子的平均平方偏差曲线和(g)锂离子的扩散系数。
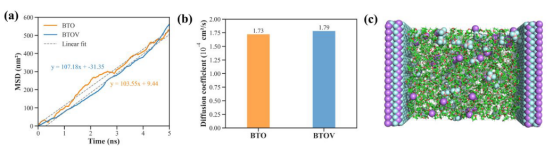
图 S25(a)质子的平均扩散距离曲线和(b)质子的扩散系数。(c)恒定电位分子动力学模拟系统的示意图。电解质由 LiBF4、乙醇和 THF组成,被限制在两个平行的平面 BTO电极之间。在电极之间施加7伏的电位差,即正极电位为 +3.5伏,负极电位为 -3.5伏。
三、计算分析3.1DFT计算分析阴离子吸附机制计算目标通过密度泛函理论(DFT)量化BF₄⁻在催化剂表面(BTO与BTOV)的吸附行为,揭示有序偶极子的作用机制。
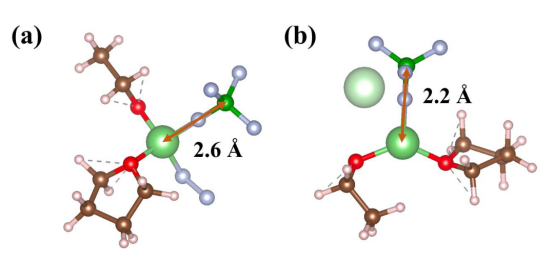
关键结果吸附能差异:BTOV对BF₄⁻的吸附能(-3.09 eV)显著强于BTO(-0.57 eV)(图4a)。 吸附构型:BTOV表面氧空位诱导的偶极子有序排列,通过静电作用特异性锚定阴离子(图S23)。
计算参数软件:VASP + PAW赝势 泛函:PBE-GGA 收敛标准:能量<2×10⁻⁶ eV,力<0.02 eV/Å k点网格:3×3×1(结构优化),6×6×1(电子结构) 范德华修正:DFT-D3
实验验证拉曼光谱直接观测电解液中阴离子配位状态: BTOV的配位阴离子比例达 66.75%(自由阴离子33.24%) BTO的配位阴离子占比不足 50% 证明有序偶极子促进阴离子富集与吸附,与DFT预测完全一致。
3.2分子动力学模拟(MD)揭示离子传输动力学模拟体系构建电解液组成:60 LiBF₄ + 20 EtOH + 1100 THF分子(图S24a, S25c)。 电极模型:BTO/BTOV[110]晶面覆盖Li₂O或LiF层。 边界条件:固定电极原子位置,施加7V电势差(+3.5V/-3.5V)。
关键发现Li⁺扩散增强:BTOV体系的Li⁺扩散系数(1.74×10⁻⁴ cm²/s)高于BTO(1.23×10⁻⁴ cm²/s)(图S24g)。 选择性传输:N₂和H⁺扩散无显著差异,证明Li⁺传输为速率决定步骤(图S25a, S26a)。
模拟参数力场:OPLS-AA 控温:Nose-Hoover (300 K) 长程静电:PME算法 模拟时长:30 ns平衡 + 20 ns生产轨迹
实验验证电化学阻抗谱(EIS)显示: BTOV的电荷转移电阻(Rct)降低56% 线性区斜率更大,证实界面离子传输加速(图3e)
3.3活化能计算解析SEI界面动力学计算方法通过变温EIS(-5°C至25°C)结合Arrhenius方程: k=Aexp(−Ea/RT) 拟合得到Li⁺脱溶剂化及跨SEI能垒(图4c-d)。
计算结果
实验关联低活化能验证了LiF-rich SEI(图4e-g)提升界面动力学,与MD模拟结果一致。
实验证据XPS深度刻蚀显示: BTOV的SEI中LiF含量在60s刻蚀后达 80% BTO的LiF含量仅 16%(图4e-g) 证明低能垒源于LiF-rich SEI,与计算预测的阴离子还原机制吻合。
3.4溶剂化结构模拟(支撑电解质设计)模型目标:对比N₂/Ar环境下Li⁺溶剂化鞘层差异。 结论:N₂环境促进阴离子(BF₄⁻)进入溶剂化鞘,加速阴离子还原形成LiF-rich SEI。 性能关联 电解液成分对比实验: 仅当含BF₄⁻和N₂时,BTOV的FE达 93.01% 移除BF₄⁻或替换为Na⁺盐时,FE骤降至 0%(表S2) 证明阴离子还原是性能提升的必要条件,与模拟结论互锁。
四、计算方法4.1密度泛函理论(DFT)计算计算目标量化BF₄⁻在BTO与BTOV催化剂表面的吸附能差异(图4a) 分析氧空位(Ov)对表面电子结构的影响
关键模型表面模型:BaTiO₃[110]晶面(无Ov为BTO,含Ov为BTOV) 吸附构型:BF₄⁻在表面最稳定吸附位点(计算模型见上图)
4.2分子动力学(MD)模拟计算目标分析Li⁺/N₂/质子在电解液中的扩散行为(图S24-S26) 揭示有序偶极子对离子传输的增强机制
参数设置(支撑信息 Section: Theoretical calculation methods)
分析方法均方位移(MSD):计算离子扩散系数(例:Li⁺在BTOV中扩散系数1.74×10⁻⁴ cm²/s) 数密度分布:统计Li⁺/N₂/质子在电极附近的浓度梯度(图S24b-c)
4.3活化能计算(基于实验数据)计算原理通过变温EIS测试(-5°C至25°C)获取动力学数据 采用Arrhenius方程拟合能垒: (其中Rₜ为电荷转移电阻,T为绝对温度)
参数来源实验设置:温度点 -5°C, 0°C, 5°C, 15°C, 25°C(支撑信息 Section: Electrochemical measurements) 测试条件:电位-0.5 V vs Liᵃᵖᵖ,频率范围100 kHz–0.1 Hz
输出结果
|