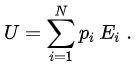|
通俗讲解:内能时间:2025-05-16 在热力学里,内能(internal energy)是热力学系统内两个具状态变数之基本状态函数的其中一个函数。内能是指系统所含有的能量,但不包含因外部力场而产生的系统整体之动能与势能。内能会因系统能量的增损而随之改变。
系统的内能可能因(1)对系统加热、(2)对系统作功,或(3)添加或移除物质而改变[1]。当系统内有不可穿透的墙阻止物质传递时,该系统称之为“封闭系统”。如此一来,热力学第一定律描述,内能的增加会等于增加的热量加上环境对该系统所做的功。若该系统周围的墙不能传递物质与能量,则该系统称之为“孤立系统”,且其内能会维持定值。
虽然内能是个宏观物理量,内能也可在微观层面上由两个假设的量来解释。一个是系统内粒子的微观运动(平移、旋转、振动)所产生的微观动能。另一个是与粒子间的化学键及组成物质的静止质量能量等微观力有关之势能。在微观的量与系统因做功、加热或物质转移而产生之能量增损的量之间,并不存在一个简单的普遍关系。
例如: 分子动能:一杯热水中,水分子快速振动、碰撞,温度越高,分子运动越剧烈,动能越大。 分子势能:冰融化成水时,虽然温度不变,但分子间距增大,势能增加。
一、与机械能的区别机械能是物体整体运动或位置的能量(如滚动的球、举高的石头),而内能是微观粒子的能量。例如: 静止的冰块仍有内能(内部分子在振动),但机械能为零。
二、内能的目的是什么?内能的核心作用是解释能量如何在物质内部存储和转化:
l 描述能量状态:内能是热力学系统的“能量账本”。例如:烧水时,热量转化为水的内能,水温升高;汽油燃烧时,化学能转化为燃气的内能,推动汽车发动机做功。
l 分析能量交换:通过内能变化,可以研究热传递和做功的规律。例如:用热水袋取暖(热传递改变内能);摩擦生热(做功改变内能)。
三、通俗案例解析冰块融化现象:0℃的冰吸收热量后融化成0℃的水,温度不变,但内能增加。 原理:热量用于打破冰的分子间束缚(增加势能),而非提高温度(动能不变)。
搓手取暖现象:双手摩擦后变热。 原理:摩擦力做功,将机械能转化为手部内能(分子运动加剧)。
高压锅喷气现象:高压锅蒸汽顶起阀门,发出“呲呲”声。 原理:蒸汽内能转化为阀门的机械能(对外做功,内能减少)。
太阳晒热石头现象:石头被阳光照射后变烫。 原理:热传递将太阳辐射能转移到石头内部分子,增加其内能。
四、微观内能的计算一系统的微观动能是该系统内所有粒子之运动的总和,包含原子、分子、原子核、电子等粒子的运动。微观势能则是指化学能与核势能,以及该系统内因为内含的电偶极矩与磁偶极矩所产生的物理力场,以及固体的形变(应力-应变)所具有之能量的总和。一般而言,宏观热力学不会讨论到微观的动能与势能。
内能不包含因系统整体的运动或位置所产生之能量,亦即排除任何因为系统于一外部重力场、静电场或电磁场之运动或位置,而产生之动能与势能。不过,系统内之物体的内含自由度与这些场耦合所产生之能量,也算是内能的一部分。在此一情形下,系统的热力学状态需要使用额外的外部参数来描述之。
就热力学及工程学上的实际用途来看,一般很少需要,或甚至不可能考虑一个系统的所有内含能量,如质量所含有的等价能量。一般而言,只有与研究的系统及程序有关的部分才会被包含进来。实际上,在大多数考量的系统内,尤其是在热力学里,计算出所有内能是不可能的。因此,通常会为内能选定一参考零值。
内能是个外延物理量,即内能与系统之大小,或系统所含物质多寡有关。
在温度大于绝对零度时,微观势能与动能间会不断地互相转换,但在一孤立系统内,其和会维持一个定值。在经典热力学的观点下,动能在绝对零度时会消失,而内能会只剩下势能。不过,量子力学表示,即使在绝对零度下,粒子仍然会有剩余的动能,即零点能量。在绝对零度的系统只会处在量子力量的基态,最低可达能量状态之下。在绝对零度时,一系统会达成其最低可达到的熵。
内能的微观动能部分取决于该系统的温度。统计力学将个别粒子半随机的动能与构成整个系统的粒子之平均动能所关连。甚至,统计力学将微观的平均动能与宏观可见的系统之温度相关连。此一能量通常被指为系统的“热能” ,并将此能量(如温度)与人们对冷热的体验相关连。
统计力学将每个系统视为是在 N 个微观状态所组成之系综下做统计上的分布。每个微观状态都具有一个能量 Ei,并有着概率 pi。内能即为该系统总能量的平均值,亦即为所有微观状态之能量,在其出现概率之加权下的总和:
这是热力学第一定律在统计下描述。 上一篇通俗讲解:势能下一篇通俗讲解:玻尔兹曼因子 |