|
通过实验探究双阴离子离子液体的细菌杀灭活性:通过分子动力学模拟揭示官能团对其作用机制的解析时间:2025-07-07
*欢迎大家去观看原文,并引用 标题:Understanding Experimentally Compatible Bactericidal Activity ofDicationic Ionic Liquids: A Mechanistic Insight into the Effect ofFunctional Groups by MD Simulations 期刊:J. Phys. Chem. B 网址:https://doi.org/10.1021/acs.jpcb.5c00942
一、文章摘要离子型液体化合物(DCILs)作为一种抗菌剂展现出极具创新性的潜力,有助于缓解全球范围内的抗生素耐药菌危机。改变离子头部基团、增加侧链长度、进行功能化处理以及调整离子液体结构的疏水/亲水特性,都会影响其与细菌细胞壁的相互作用强度。然而,要充分实现具有多种功能和结构的 DCILs 的抗菌机制,需要深入的分子层面的见解。在此,我们基于最近研究的双咪唑鎓二溴盐家族,选择了三种 DCILs,即 DCIL-1、DCIL-3 和 DCIL-5,它们的官能团分别为2-羟基丁基、2-羟基-3-(甲基丙烯酰氧基)丙基和2-羟基-3-苯氧基丙基。当前的全原子分子动力学(MD)模拟和自由能计算与我们之前的实验测定结果一致,证实了它们对大肠杆菌(E.coli)的杀菌活性的顺序为(DCIL-5 > DCIL-1 > DCIL-3)。离子对的插入是破坏细菌双层膜并使其破裂的主要驱动力。分子动力学模拟结果表明,大分子 DCIL 的抗菌活性是由于静电相互作用和疏水相互作用的共同作用所致。此外,还揭示了其抗菌机制,即通过静电吸引力将二聚体吸附在细菌膜脂质上,二聚体的翻转运动使其在靠近脂质双层表面的区域找到合适的定向位置,同时与脂质的头部形成关键的氢键,以促进相邻疏水基团向脂质双层中心的渗透。渗透过程可以增加每个脂质的平均表面积,降低脂质尾部的有序性以及双层厚度,提高脂质的横向扩散和双层的流动性,从而导致脂质双层破裂和细菌膜溶解。这种最强的抗菌活性。
二、计算图文
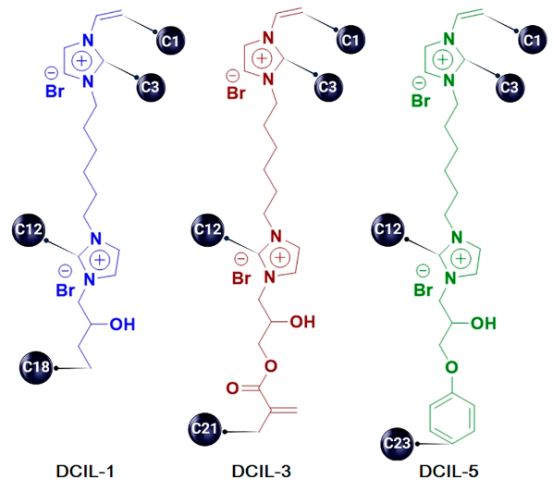
图 1.来自双咪唑鎓二溴盐家族的三种靶向抗菌化合物的结构式,其中标注了关键原子。
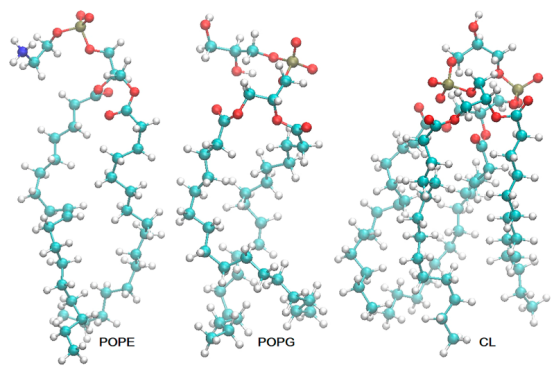
图 2.在分子动力学模拟中,构成大肠杆菌三元双层膜模型的三种磷脂的结构(90个卵磷脂、24个棕榈磷脂酰甘油和6个胆固醇)。
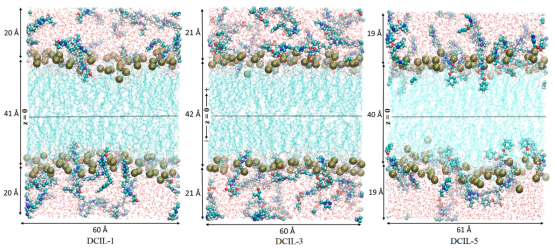
图 3.在200 纳秒后对模拟盒的最终截面图,其在 z 和 x 方向上的大致尺寸已显示出来。在这些截面图中可以看到阴离子的吸附以及它们插入脂质双层的情况。阴离子用范德华模型表示,脂质头部中的 P原子用球体表示,脂肪酸烃链用青色表示。
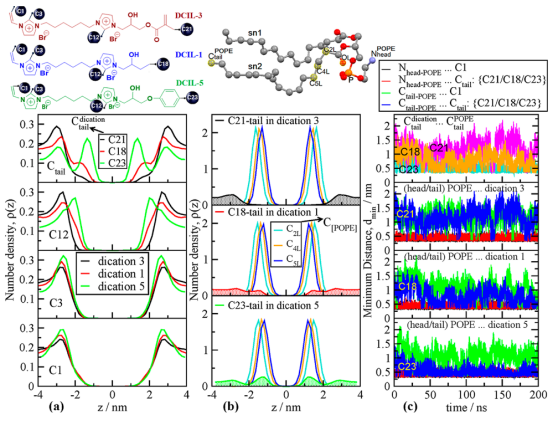
图 4.(a)对于四种不同电荷的碳原子,沿垂直于脂质双层表面的方向(即 z 方向)的密度分布ρ(z) 的比较。脂质双层膜的中心位于 z =0处。(b)将 POPE 分子中 sn2链上的三个碳原子的ρ(z) 与三个含电荷体系的关键尾部碳原子的ρ(z)进行比较。(c)在200 纳秒的模拟期间,计算出头部氮原子或 POPE脂质的尾部碳原子与每个电荷体两侧的尾部碳原子之间的最小距离。DCILs、POPE 分子以及一些原子标记被嵌入在图表的顶部。
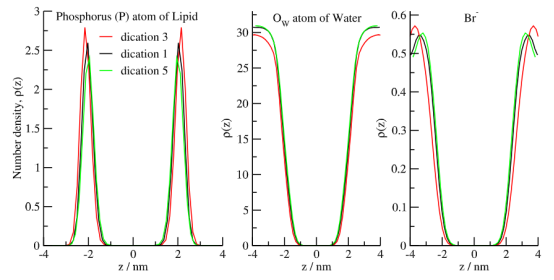
图 5.通过对水合双层系统中三种考虑的直流离子液体进行模拟,计算出了磷原子在 z 方向上的平均数量密度分布、水的氧原子以及溴离子的分布情况。
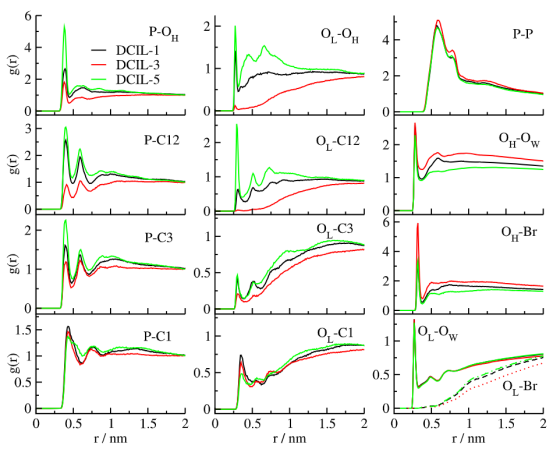
图6.三种含 DCIL 的体系中关键阳离子(C1、C3、C12、OH)与脂质双层的 POPE原子位点(P、OL)之间的部分径向分布函数 g(r) 的比较情况,展示于左侧和中间的图表中。右侧图中的(P-P)以及其他一些对称结构相关性,包括脂质氧原子或阳离子羟基氧原子与水氧原子或 Br− 的相关性,均进行了比较。
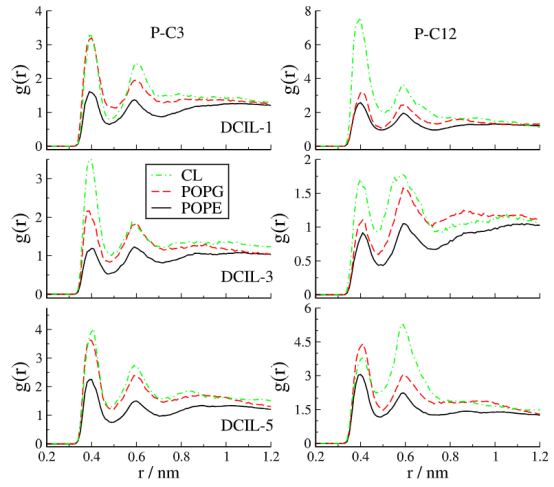
图 7.对三种大肠杆菌膜模型中磷脂头部的磷(P)原子与三种双咪唑鎓离子的钥匙环的碳(C3 和 C12)原子之间的结构相关性的比较。
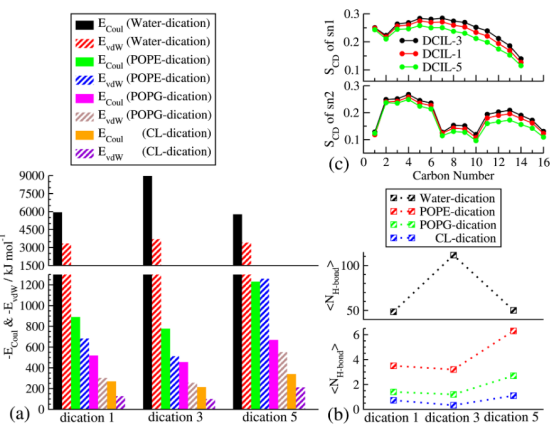
图8. (a)计算每个二聚体与水或 POPE/POPG/CL脂质之间相互分子间(库仑力和范德华力)作用的绝对值。 (b)二聚体与水或 POPE/POPG/CL脂质之间氢键的平均数量。 (c)水合 POPE脂质双层与三个 DCIL相接触时,sn1(油酰链)和 sn2(棕榈酰链)尾部的氘序参数 SCD。碳1指连接到极性头部基团的碳原子,碳原子的编号顺序朝向尾部甲基组递增。
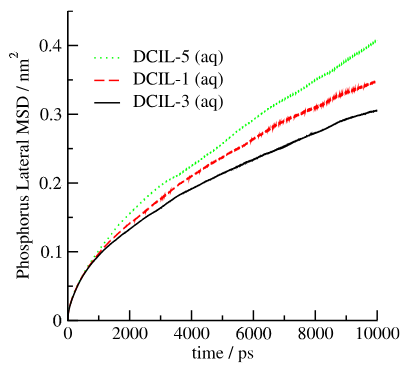
图9. 在存在水性直流离子液体的条件下,模拟最后10,000 帧中脂质膜头部磷原子沿 x-y平面的计算侧向平均滑动距离。
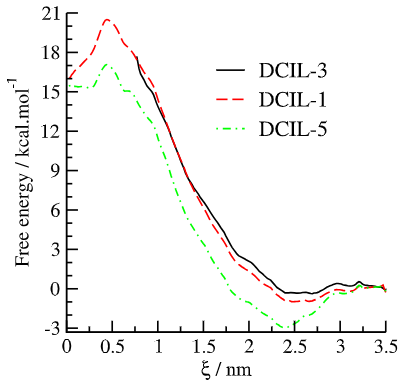
图 10.采用伞状采样方法,以中心处的复合离子-脂质距离(ξ)作为反应坐标,研究了从水相向脂质双层中心插入二聚体离子的过程中的自由能曲线。
三、计算分析文章通过MD模拟分析了多个关键维度,以揭示DCILs的杀菌机制与功能基团效应。这些分析不仅量化了离子-脂质相互作用,还动态追踪了膜破坏过程,与实验观察(如杀菌活性顺序DCIL-5 > DCIL-1 > DCIL-3)高度一致。具体分析内容如下:
3.1. DCILs在膜表面的吸附与插入过程分析目的:理解DCILs如何初始吸附并穿透脂质双层,这是杀菌机制的第一步。模拟显示,功能基团(如DCIL-5的苯氧基)通过疏水性和静电吸引驱动插入。 关键发现:DCILs通过“翻转运动”(flip motion)调整方向,使带正电的咪唑环吸附在带负电的脂质头基(如磷酸基),而疏水尾基插入脂质尾区。DCIL-5的插入最深,因其苯氧基的强疏水性,导致膜空隙增加;而DCIL-3(含亲水性甲基丙烯酰氧基)插入较弱。 支持数据:轨迹分析(如视频快照)和密度分布图显示插入深度差异。例如,原子数密度剖面(图4a)表明DCIL-5的C23原子(苯环碳)峰值位于膜中心附近(z ≈ ±1.3 nm),而DCIL-3的C21原子密度峰值较弱。 科研意义:此过程解释了杀菌活性差异——深度插入扰乱膜完整性,导致细胞裂解。
3.2. DCILs与膜组分的相互作用分析分析目的:量化静电、范德华和氢键作用,以阐明功能基团如何影响结合强度。 关键发现: 静电与范德华作用:DCIL-5与脂质(尤其是心磷脂CL)的库仑和范德华吸引力最强(例如,DCIL-5与CL的相互作用能达-92 kJ/mol),因其苯氧基增强疏水性(表S1)。相反,DCIL-3与水分子作用更强,抑制其膜吸附。
氢键网络:DCIL-5的羟基(OH)与脂质头基(如POPE的磷酸基)形成稳定氢键(平均H键数6.3),促进尾基插入(图S5)。相比之下,DCIL-3的H键主要与水分子形成(平均111.5),削弱膜作用。
科研意义:功能基团的亲/疏水平衡(如DCIL-5的高脂溶性)是高效杀菌的关键,此结果为理性设计抗菌剂提供靶点。
3.3. 膜结构性质的变化分析目的:评估DCIL插入如何改变膜物理性质(如厚度、流动性),直接关联杀菌效果。 关键发现: 膜厚度与表面积:DCIL插入增加平均脂质表面积(〈APL〉),降低膜厚度。DCIL-5引起最大变化(厚度减少至4.16 nm,〈APL〉增至0.629 nm²),因疏水尾基扰动脂质排列(表2)。 脂质链序参数:氘序参数(SCD)分析显示,DCIL-5使脂质尾链(sn1和sn2)无序化(SCD值最低),表明膜流动性增强(图8c)。这通过横向扩散系数(~10⁻⁸ cm²/s)量化,DCIL-5处理的脂质MSD最大(图9)。
- 局部结构扰动:径向分布函数(RDFs)揭示DCIL-5的C12原子(咪唑环碳)与脂质磷原子(P)强相关(峰值在0.4 nm),而DCIL-3无此特征(图6),表明功能基团影响局部插入。
科研意义:膜增溶(thinning)和流动性增加是杀菌的直接机制,模拟数据与实验观察的膜破裂现象一致。
3.4. 自由能分析与渗透性分析目的:计算DCIL跨膜的自由能曲线,预测渗透性。 关键发现:伞形采样(umbrella sampling)显示,DCIL-5在膜界面处自由能最低(-3 kcal/mol,图10),因羟基和苯氧基协同作用降低能垒。相反,DCIL-3能垒较高(-0.5 kcal/mol),渗透性差。
科研意义:自由能曲线定量解释了杀菌活性顺序,验证了“吸附-插入”机制的动力学可行性。
3.5. 功能基团特异性比较分析目的:直接对比不同功能基团(如DCIL-5的苯氧基 vs. DCIL-3的甲基丙烯酰氧基)的影响。 关键发现:通过最小距离分析(图4c),DCIL-5的尾基与脂质尾碳距离最短(平均0.71 nm),而DCIL-3最长(1.20 nm),突显疏水基团的关键作用。 科研意义:此分析指导抗菌剂优化——高疏水基团(如芳香环)提升膜穿透效率。
3.6关联逻辑框架作者采用 “实验现象→计算机制→双向验证” 的闭环策略:实验起点:前期实验测定五种DCILs的抗菌活性(MIC/MBC、活死染色、SEM形貌),发现活性顺序:DCIL-5 > DCIL-1 > DCIL-3(文档2, 1.引言及3.1节)。 计算解析:通过MD模拟揭示微观机制——功能基团通过调控疏水性、静电作用和膜扰动强度影响活性。 双向验证:正向:计算预测的活性顺序与实验一致,解释差异根源。 反向:实验观察的膜破裂(SEM)与模拟的膜结构变化(厚度、流动性)直接对应。
3.7具体关联证据活性顺序的微观解释实验数据:DCIL-5对E. coli的杀菌活性最强(MIC最低),DCIL-3最弱(文档2, 3.1节)。 计算验证: 插入深度:DCIL-5的苯氧基深入脂质尾区(z密度峰值在±1.3 nm),而DCIL-3滞留界面(图4a)。 膜扰动强度:DCIL-5使膜厚度↓12%(4.28→4.16 nm)、脂质序参数↓,而DCIL-3影响微弱(表2及图8c)。
膜破坏机制的可视化对应实验现象:SEM显示DCIL-5处理的细菌膜严重破裂,DCIL-3仅轻微变形(文档2, 1.引言)。 模拟证据: 最终构象:DCIL-5贯穿脂质双层,脂质尾链紊乱;DCIL-3仅吸附表面(图3)。 自由能壁垒:DCIL-5跨膜能垒最低(-3 kcal/mol),解释其快速渗透(图10),匹配实验杀菌速度。
功能基团作用的定量关联实验对比:疏水性排序(DCIL-5 > DCIL-1 > DCIL-3)与活性正相关(文档2, 3.1.5节)。 计算量化: 疏水作用:DCIL-5与脂质的范德华能(-1259.5 kJ/mol)是DCIL-3(-511.6 kJ/mol)的2.5倍(表S1)。 氢键网络:DCIL-5与脂质头基形成6.3个H键(稳定吸附),而DCIL-3主要结合水分子(111.5个H键),抑制膜插入(表S2)。
3.8协同验证方法论计算为实验提供机制画像
实验验证计算预测预测活性顺序:模拟得出的膜扰动强度(DCIL-5 > DCIL-1 > DCIL-3)与MBC实验完全一致。 分子设计指导:计算揭示苯氧基提升活性的机制(疏水+静电协同),指导后续实验合成高活性DCIL变体。
局限性互补实验盲点:无法实时观测原子级插入过程 → 模拟补充:动态轨迹展示翻转吸附-插入机制(支持视频)。 计算简化:膜模型忽略蛋白质 → 实验补充:SEM证实整体膜完整性破坏。
四、计算方法本文采用全原子分子动力学(MD)模拟和自由能计算,系统研究三种二价离子液体(DCILs)与大肠杆菌膜模型的相互作用。以下从计算框架、参数设置、模拟流程三方面展开,严格依据文档2的“Computational Method”(第2节)及支持信息中的数据。
4.1. 分子动力学(MD)模拟使用 GROMACS 5.0.4 进行模拟。 运动方程积分:蛙跳算法(leapfrog),时间步长 2 fs。 系综控制:NPT系综(恒定粒子数、压力、温度),温度310 K(生理温度),压力1 bar。 控温/压方法:Nosé-Hoover恒温器(弛豫时间0.5 ps) + Parrinello-Rahman恒压器(弛豫时间2 ps),半各向同性耦合(z轴独立缩放)。
4.2. 自由能计算伞形采样(Umbrella Sampling) 目的:计算DCIL跨膜自由能曲线(PMF)。 反应坐标:二价阳离子(dication)质心(COM)与膜中心的距离(ξ)。 流程: 牵引模拟(Steered MD):以速率 0.01 nm/ps 将dication从水相拉至膜中心,生成初始构型。 采样窗口:沿ξ轴每 0.10 nm 设一个窗口,共覆盖膜界面至中心。 采样时长:每个窗口平衡 10 ns,正式采样 40 ns(文档2, 2.2节)。 数据分析:用 WHAM(加权直方图分析法) 整合数据,生成PMF曲线(图10)。
4.3关键参数与力场设置膜模型构建脂质组成:三元磷脂双层(模拟E. coli内膜) 90个POPE(两性离子脂质) 24个POPG(带负电,电荷-1) 6个心磷脂(CL)(带负电,电荷-2) 构建工具:CHARMM-GUI 膜构建器(文档2, 2.1节)。 水化层:每层脂质双层外包裹 ~25 Å厚TIP3P水分子(参考文献65)。 电荷中和:添加 36个Na⁺(因POPG和CL总负电荷为-36)。
力场选择
相互作用计算参数静电作用: 长程:粒子网格Ewald(PME)法(文献75)。 短程:截断半径 1.2 nm。 范德华作用: Lennard-Jones势,截断半径 1.2 nm,混合规则 Lorentz-Berthelot。 键约束: 含氢键用 LINCS算法 约束(文献76)。 邻近列表更新:每 5步(10 fs)更新一次。
模拟体系细节
4.4模拟流程与验证模拟步骤能量最小化:最陡下降法,约束溶质(力常数1000 kJ/mol/nm²)。 平衡阶段: NVT系综 1 ns → NPT系综 1 ns(310 K, 1 bar)。 生产模拟: NPT系综 200 ns,最后100 ns用于数据分析(文档2, 2.1节)。 DCIL添加: 在平衡后膜体系中插入 32个DCIL离子对(32 dications + 64 Br⁻),替代部分水分子。
关键分析工具(GROMACS内置)结构分析: 密度分布:gmx density(生成z轴密度剖面,图4a)。 径向分布函数:gmx rdf(计算原子间距,图6)。 相互作用能:gmx energy(分解库仑/范德华能,表S1)。 氢键统计:gmx hbond(标准:距离<0.35 nm,角度>30°,表S2)。 序参数:gmx order(计算脂质尾链SCD值,图8c)。 扩散系数:gmx msd(脂质头基P原子横向MSD,图9)。
收敛性验证时间尺度:200 ns模拟,最后100 ns数据用于分析(插入dication数趋于稳定)。 能量监测:体系总能量、温度、压力波动在合理范围内。 实验一致性:模拟预测的杀菌活性顺序(DCIL-5 > DCIL-1 > DCIL-3)与实验MBC值吻合(文档2, 3.1节)。
4.5参数选择的科学依据力场可靠性:CHARMM36广泛验证于磷脂膜,CGenFF适用于离子液体参数化(文献48, 52)。 水模型:TIP3P兼顾计算效率与生物体系准确性(文献65)。 采样时长:200 ns确保膜-离子体系平衡(文献44, 54)。 自由能精度:40 ns/窗口 + WHAM整合,可收敛PMF曲线(文献77)。 局限性说明:模拟浓度(~16–18 wt%)高于实验MIC值,但因计算成本限制,仍能反映机制趋势(文档2, 4节)。
|