|
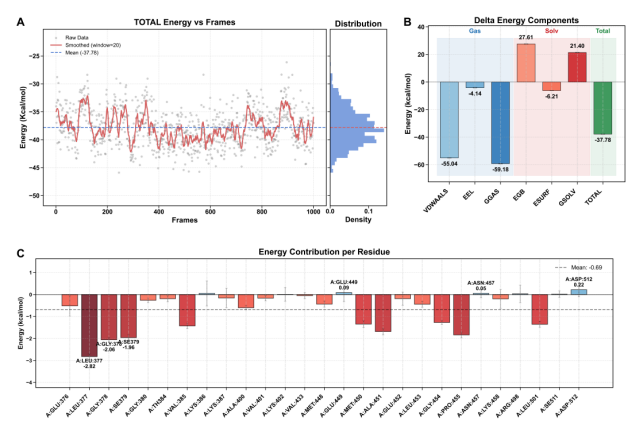
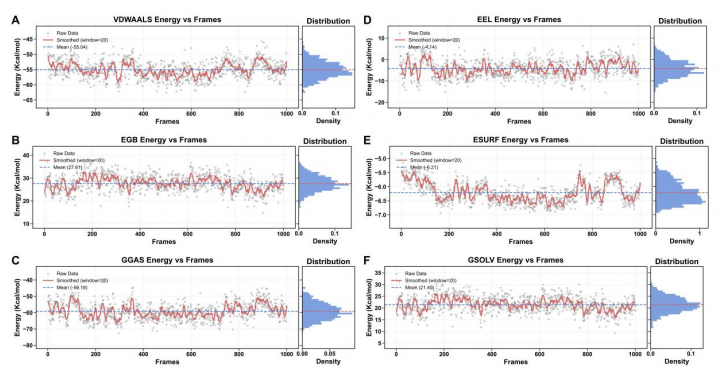
结合自由能分析时间:2025-04-28 分子力学-广义玻恩表面积(MM-GBSA)方法是一种计算蛋白质-配体结合自由能的常用技术。该方法通过将分子力学能量与溶剂化自由能相结合,估算结合过程中的能量变化。各能量项的物理意义如下:VDWAALS 代表范德华相互作用,EEL 表示静电相互作用,GGAS 是气相自由能(VDWAALS 和 EEL 之和),EGB 和 ESURF 分别代表极性和非极性溶剂化效应,GSOLV 是溶剂化自由能(EGB 和 ESURF 之和),TOTAL 是总结合自由能(GGAS 和 GSOLV 之和)。这些能量项共同决定了蛋白质与配体之间的结合强度和稳定性。蛋白 B 蛋白与小分子 C 蛋白复合物的结合自由能分析如图 1-7 所示,图 1-7A 中的能量轨迹显示,总结合能量在模拟过程中相对稳定,表明复合物的结合模式具有较好的稳定性。图 1-7B 中的能量组分分析表明,范德华相互作用(VDWAALS)和静电相互作用(EEL)是主要的结合驱动力,而溶剂化效应在一定程度上抵消了这些作用。图 1-7C 中的关键残基分析揭示了对结合有显著贡献的残基,其中一些残基的能量贡献为负值,表明它们有利于小分子的结合,而正值则不利于结合。 结合自由能的负值(-37.78 kcal/mol)表明蛋白质与配体之间存在较强的结合作用,这与 RMSD、RMSF、Rg、Ramachandran 分析、PCA 和氢键分析的结果相一致,进一步证实了复合物的结构稳定性和结合模式的可靠性。这些分析结果为理解蛋白质-配体相互作用提供了全面的视角,并为药物设计和优化提供了科学依据。通过识别关键残基和能量组分,可以针对性地进行结构改造,以增强结合亲和力和选择性。蛋白 B 蛋白与小分子 C 复合物的结合自由能组分分析如图 1-8 所示,从图 1-8A 至图 1-8F 的能量轨迹图可以看出,各能量组分在模拟过程中均表现出较好的稳定性,平均值线(蓝色虚线)表明了各能量组分的稳定性和平衡性。图 1-8A和图 1-8D 显示,范德华相互作用能和静电相互作用能在整个模拟过程中波动较小,表明这两种相互作用对结合能的贡献较为稳定。图 1-8B 和图 1-8E 显示,广义 Born 极化溶剂化能和表面积相关能量的波动也较小,说明溶剂化效应对结合能的影响相对稳定。图 1-8C 和图 1-8F 进一步揭示了气相自由能和溶剂化自由能的变化趋势,为理解蛋白质-配体相互作用的热力学性质提供了重要信息。
蛋白 B-小分子 C 复合物的 MM-GBSA 结合自由能分析
蛋白 B-小分子 C 复合物的 MM-GBSA 结合能量组分分析 该案例由生物计算团队案例提供 如果需代算可联系中介-邱新龙帮忙联系 +V 19907905031 具体项目方案,双方进行明确沟通 |