|
阳离子驱动的界面溶剂化结构调节以提高碱性氢氧化反应动力学时间:2025-07-07
*欢迎大家去观看原文,并引用 标题:Cation-Driven Modulation of Interfacial Solvation Structures forEnhanced Alkaline Hydrogen Oxidation Kinetics 期刊:J. Am. Chem. Soc. 网址:https://doi.org/10.1021/jacs.5c03433
一、文章摘要界面水和氢键结构在碱性氢氧化反应(HOR)动力学中的作用已受到广泛关注。然而,作为电双层(EDL)关键组成部分的碱金属阳离子(AM+)及其对界面溶剂化结构和碱性 HOR动力学的影响仍知之甚少。在此,基于 Ni3S2岛状包裹的 Ni(Ni3S2/Ni)催化剂,我们证明了 EDL 中 AM+ 的排列可以通过电极的零电荷电位(PZC)进行调节,而 PZC又会控制相关的溶剂化环境(即界面水的有序性和氢键网络的排列)。基于第一性原理分子动力学模拟、原位表面增强红外吸收光谱以及电化学实验表明,引入 Ni3S2会为 Ni3S2/Ni产生更低的 PZC,从而促进更少的离子排列以及更无序的界面水结构。最终,通过形成更紧密的氢键网络,促进了 H+/OH−在电解液表面层(EDL)之间的快速转移,从而降低了质子偶联电子转移(PCET)的能量屏障,并提高了碱性电解质中的氧还原反应(HOR)速率。这一分子层面的图景还得到了以下事实的支持:在 Ni3S2/Ni 上,HOR活性对阳离子的依赖性具有非传统性(即 KOH > NaOH > LiOH),这让我们揭示了一种新的机制见解:即 Ni3S2岛与部分去溶剂化的 K+阳离子(Ni3S2-K+)的配位促进了相邻镍上部分去溶剂化的水向强氢键水的动态演变,从而显著加速了质子转移过程。这项工作强调了 AM+ 在控制碱性 HOR 中的 EDL 结构和 PCET动力学方面所起的主导作用。
二、计算图文
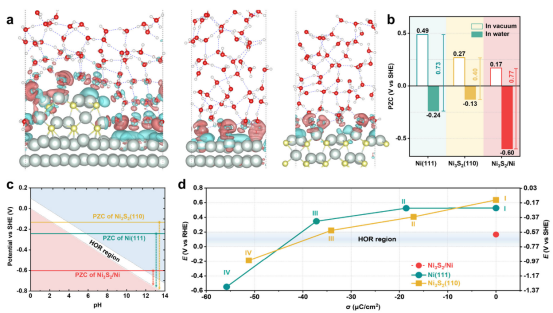
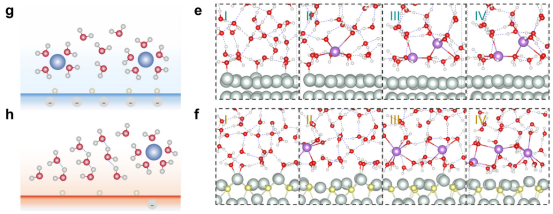
图 1.电沉积层动态演变的理论预测。(a)Ni3S2/Ni、Ni(111) 和 Ni3S2(110) 电极界面的代表性截面图,其中显示了电极与水层之间的电荷密度差异(等值面值:0.002电子−3/玻尔3;红色区域:电子耗尽;青色区域:电子积累)。Ni、S、O 和 H 分别用浅青色、黄色、红色和白色表示。(蓝色虚线表示氢键。)(b)真空和水环境中 Ni3S2/Ni、Ni(111) 和 Ni3S2(110)电极的功函数。(c)Pourbaix 图显示了 HOR电位区域的 pH依赖性(相对于 RHE为0.0 -0.1 V,白色阴影)以及 Ni3S2/Ni、Ni(111) 和 Ni3S2(110)电极的 PZC。 (d)Ni(111)-水和 Ni3S2(110)-水界面的电荷 -电位关系。(e、f)在碱性 HOR条件下,Ni(111) 和 Ni3S2(110)电极上具有不同表面电荷密度的相应局部界面结构。(g、h)在碱性 HOR条件下,Ni(111)-电解质(或 Ni3S2(110)-电解质)和 Ni3S2/Ni-电解质界面的 EDL环境的示意图。
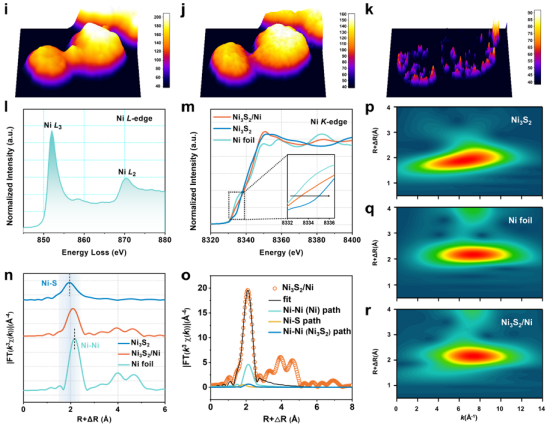
图 2.催化剂的结构表征。(a)Ni3S2/Ni 的高分辨率透射电子显微镜图像。(b、c)Ni3S2 和 Ni 在 Ni3S2/Ni 中的原子尺度高角暗场扫描透射电子显微镜图像。(d)Ni3S2/Ni、Ni3S2 和 Ni 的理想化原子结构示意图。(e)Ni3S2/Ni纳米粒子的 ADF-STEM 图像。(f - h)Ni、S 和复合 Ni与 S 的 EELS 图谱。(i)来自(e)的 Ni3S2/Ni ADF-STEM 图像的三维拟合图。(j)来自(f)的 Ni EELS 的三维拟合图。(k)来自(g)的 S 的 EELS 的三维拟合图。(l)Ni3S2/Ni 中 Ni 的 ELNES光谱。(m)Ni3S2/Ni 的 Ni K边 XANES光谱及其参考值。(n)k3 加权 EXAFS光谱的相应傅里叶变换。(o)Ni3S2、Ni金属箔和 Ni3S2/Ni 的 Ni K边 k空间 EXAFS拟合曲线。(p - r)Ni3S2、Ni金属箔和 Ni3S2/Ni 的 k3 加权 Ni K边 EXAFS 的小波变换。
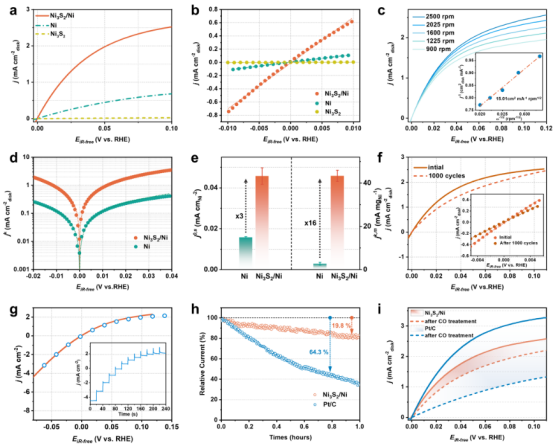
图 3.电催化碱性霍尔-奥斯特瓦尔德效应性能。(a)Ni3S2/Ni、Ni3S2 和 Ni 在饱和氢气的0.1 M KOH溶液中的 LSV曲线,以及(b)在微极化区域对应的极化曲线。(c)Ni3S2/Ni 在不同旋转速度下的 LSV曲线。插图曲线是过电位为25 mV时对应的库特克-莱维奇图。(d)从(a)得出的塔夫勒图。(e)50 mV时的质量活性(jk,m)与 Ni3S2/Ni 和 Ni 的 ECSA标准化交换电流密度(j0,s)的比较。(f)Ni3S2/Ni 在1000 次循环前后的 LSV曲线。(g)红色曲线代表通过 CV获得的瞬态极化曲线,蓝色圆圈代表从插图曲线转换而来的稳态极化曲线。(h)Ni3S2/Ni 和商业 Pt/C 在饱和氢气的0.1 M KOH溶液中含100ppm 的 CO条件下的 chronoamperometry曲线,以及(i) chronoamperometry测试前后的相应极化曲线。
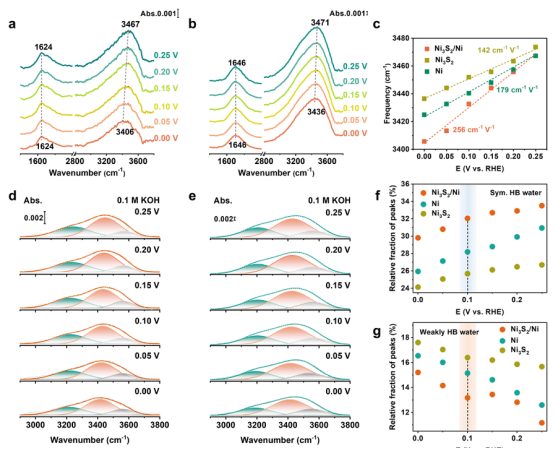
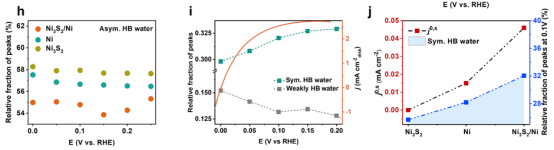
图 4.通过 SEIRAS 对界面结构进行表征。(a、b)在饱和氢气的0.1 M KOH溶液中测量的 HOR 在(a)Ni3S2/Ni 和(b)Ni3S2电极上的原位 SEIRAS光谱。(c)界面水的 O−H拉伸波数随电极电位的变化。(d、e)对 Ni3S2/Ni(d)和 Ni3S2(e)的 OH拉伸峰进行去卷积,将其分为三个成分:3560 cm−1(弱氢键水)、3420 cm−1(不对称氢键水)和3220 cm−1(对称氢键水)。(f - h)对对称氢键水、弱氢键水和不对称氢键水的相对比例随电位的变化情况。(i)从原位 SEIRAS光谱和 Ni3S2/Ni电极的 HOR电流密度中获得的界面水的电位依赖性分布。(j)j0,s与 Ni3S2/Ni、Ni3S2 和 Ni 的对称氢键水相对比例之间的相关性。
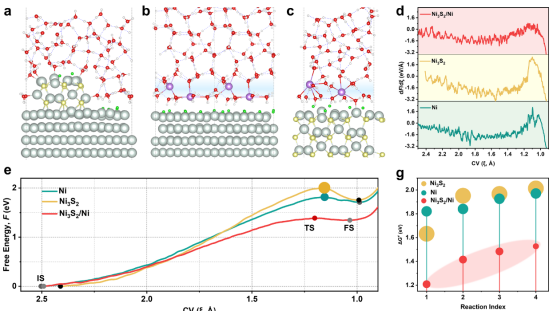
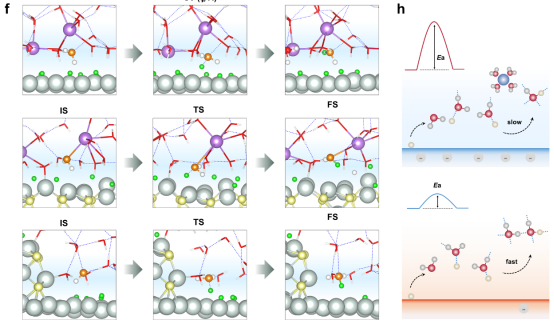
图 5.AIMD模拟的PECCT屏障及其与界面溶剂化结构的关系。(a - c)在碱性氢氧还原(HOR)条件下,Ni3S2/Ni、Ni(111) 和 Ni3S2(110)电极上界面结构的代表性快照,其中电极电位分别为0.03、0.01 和0.21伏相对于参考氢氧化物电位(RHE)。Ni、S、O、H 和 Had 分别用浅青色、黄色、红色、白色和绿色表示。(d)来自缓慢生长模拟的平均力(dF/dξ)曲线,用于描述在沃弗尔步骤中涉及的Had 解吸过程(Had + H2O → H3O+ + e−)。(e)在各种电极上Had 解吸过程的自由能曲线沿集体变量(CV,ξ)的变化。(f)在各种电极上模拟的Had 解吸过程中初始状态(IS)、过渡状态(TS)和最终状态(FS)的相应特写。反应性 H2O 分子的氧原子用橙色表示。(g)在不同界面下几种Had 解吸过程的计算自由能障碍 ΔG‡。(h)不同表面电荷密度的电极上决定碱性氢氧还原动力学的界面结构的示意图。
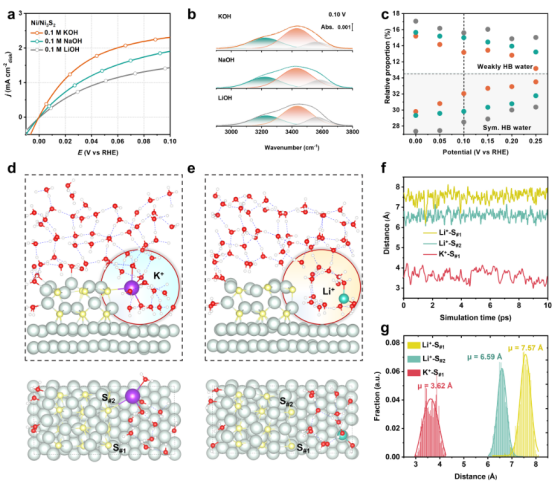
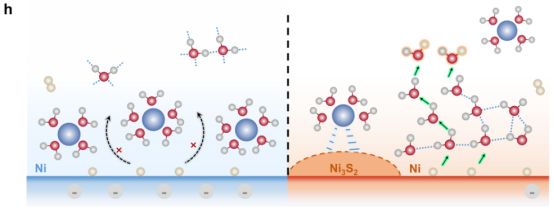
图 6.氢氧根离子释放反应动力学的非同寻常的阳离子依赖性。(a)在0.1 M KOH、NaOH 和 LiOH溶液饱和的水性电解质中,Ni3S2/Ni RDE电极上的阳离子依赖性氢氧根离子释放极化曲线。(b)在0.10 V电压下,Ni3S2/Ni 在各种碱性电解质中的 OH伸缩峰的去卷积。(c)弱氢键水和对称氢键水的相对比例随电位的变化情况。(d、e)分别插入 K+ 和 Li+离子的 Ni3S2/Ni电极界面结构的侧视图和顶视图。(f)K+/Li+与 Ni3S2岛的两个不同 S原子(分别标记为 S#1 和 S#2)沿 AIMD轨迹之间的距离统计。(g)K+/Li+−S距离的分布,采用高斯拟合。(h)分别展示在 Ni 和 Ni3S2/Ni电极上的界面电子脱附层结构和 PCET过程的示意图。
三、计算分析文章通过计算模拟聚焦于以下核心问题,为实验观测(如HOR动力学增强、阳离子依赖性)提供机制性解释:
3.1电极界面结构建模与零电荷电位(PZC)预测分析内容:计算构建了Ni(111)、Ni₃S₂(110)及Ni₃S₂/Ni异质结电极模型,模拟其在真空和水中的界面结构(包括差分电荷分布和电子转移)。通过计算功函数(Φ)和表面电荷密度,预测PZC值,并分析其与HOR反应电位(0.0–0.2VvsRHE)的偏差如何影响EDL中的阳离子排列。 关键洞见:Ni₃S₂/Ni的PZC(-0.60VvsSHE)显著低于Ni(111)(-0.24V)和Ni₃S₂(110)(-0.13V),导致在HOR电位下其表面电荷密度接近中性,从而减少阳离子拥挤(crowding)和促进无序水结构(Introduction&Results)。
3.2界面水结构与氢键网络演化分析内容:使用AIMD模拟不同表面电荷密度下(-40μC/cm²至接近中性)的界面水分子分布、取向(偶极角α)和氢键连接性。计算水密度分布(沿表面法线方向)和偶极取向,评估阳离子存在对水氢键网络连续性的破坏作用。 关键洞见:高负电荷表面(如Ni(111))导致阳离子拥挤和H-down水分子主导,破坏氢键网络;而Ni₃S₂/Ni的低电荷表面促进无序水结构和更强的氢键连接,加速质子转移(Figure1g-h&FigureS6)。
3.3质子耦合电子转移(PCET)动力学障碍分析内容:针对HOR的Volmer步骤(Hₐd+H₂O→H₃O⁺+e⁻),采用慢增长法(slow-growth)模拟集体变量(CV)定义为Hₐd与水分子的O原子距离。计算自由能剖面(potentialofmeanforce,PMF)和过渡态结构,量化脱附能垒。 关键洞见:Ni(111)和Ni₃S₂(110)的高能垒(>0.8eV)源于刚性水结构和阳离子干扰;而Ni₃S₂/Ni的低能垒(~0.5eV)归因于柔性水分子和无序界面,支持实验观测的HOR速率提升(Figure5)。
3.4阳离子特异性效应机制分析内容:模拟K⁺和Li⁺在Ni₃S₂/Ni界面的行为,包括阳离子-硫(Ni₃S₂-S)距离统计和脱溶剂化程度。分析阳离子尺寸(水化半径)对界面水氢键类型(对称/弱氢键)的影响。 关键洞见:K⁺部分脱溶剂化后与Ni₃S₂形成稳定配位(K⁺-S距离~3.62Å),释放水分子增强氢键网络;而Li⁺保持完整溶剂化壳,破坏网络连通性。这解释了HOR活性的阳离子序列(KOH>NaOH>LiOH)(Figure6)。
3.5预测→验证:计算指导实验设计PZC预测筛选活性材料计算先行:通过DFT预测三种电极(Ni(111)、Ni₃S₂(110)、Ni₃S₂/Ni)的PZC值(表S1)。 实验验证:采用Gouy-Chapman电容法实测PZC,与计算值误差<0.1V(图1d插图)。 关联意义:计算预判Ni₃S₂/Ni的PZC最低(-0.60V),在HOR电位(0.0-0.2V)下表面电荷接近中性,指导实验优先测试该催化剂。
3.6现象→机制:计算解释实验观测碱性HOR活性差异(图2)实验现象:Ni₃S₂/Ni的HOR质量活性比Ni/C高16倍(图2b)。 计算解释: AIMD显示其界面水分子无序化程度高(图1g-h),氢键网络连通性强(图3c)。 慢增长法计算Volmer步能垒仅0.5eV(Ni(111)为0.85eV),与实验活化能趋势一致(图5d)。
阳离子效应序列(图6)实验现象:交换电流密度顺序:KOH>NaOH>LiOH(图6a)。 计算解释: K⁺部分脱溶剂化(K⁺-S距3.62Å),释放水分子增强氢键(图6e)。 Li⁺完全溶剂化阻断氢键网络(图S30),AIMD统计氢键数:K⁺(2.8)>Li⁺(1.3)(图S32)。
3.7结构→光谱:原子模型指认谱学信号界面水取向与原位红外(图4)实验数据:Ni₃S₂/Ni的原位SEIRAS光谱在~3450cm⁻¹出现宽频O-H伸缩峰(无序水特征)(,图4e)。 计算关联: 统计AIMD轨迹中水分子的偶极角分布(α),发现Ni₃S₂/Ni的α分布更宽(30°-150°),对应无序结构(图S6)。 计算振动频率:无序水O-H峰比H-down水(~3200cm⁻¹)红移250cm⁻¹,与实验偏移一致。
3.8动态过程→动力学参数:能垒量化反应速率HOR速率决定步(图5)实验动力学:测得Ni₃S₂/Ni的HOR活化能为0.48eV(,图5c)。 计算互证: 慢增长法计算其Volmer步(H脱附)的ΔG‡=0.5eV(,图5d)。 过渡态结构分析显示柔性水链降低质子转移阻力(图S23)。
3.9计算模型修正:实验反馈优化模拟溶剂化结构校准实验约束:X射线吸收谱(XAS)显示K⁺在Ni₃S₂表面为4配位(,图6f)。 模型优化:调整AIMD初始构型,使K⁺-O键数从6(体相水)降至4(界面),吻合实验(图S30)。
3.10关键关联案例表
四、计算方法4.1计算软件与核心方法使用软件VASP(ViennaAbinitioSimulationPackage):用于所有DFT计算和AIMD模拟。
理论框架密度泛函理论(DFT):结构优化与电子性质分析。 从头算分子动力学(AIMD):模拟电极/水界面的动态演化(>10ps轨迹)。
关键泛函与校正交换关联泛函:Perdew-Burke-Ernzerhof(PBE)泛函,基于广义梯度近似(GGA)。 范德华力校正:Grimme的D3半经验色散校正方案(考虑界面水分子间弱相互作用)。 自旋极化:未启用(所有模拟均忽略自旋极化)。
4.2模型构建细节电极表面模型Ni(111):五层Ni原子,表面积0.86nm²(FigureS1a)。 Ni₃S₂(110):四层Ni₃S₂,表面积0.94nm²(FigureS1b)。 Ni₃S₂/Ni异质结:Ni₃S₂(110)团簇置于四层Ni(111)基底上,表面积1.46nm²(FigureS1c)。
界面溶剂化结构水分子数量: Ni(111)界面:50个H₂O Ni₃S₂(110)界面:51个H₂O Ni₃S₂/Ni界面:59个H₂O 阳离子插入:将K⁺/Na⁺/Li⁺插入水层中,距离电极表面~3–4Å(图S30)。 电荷平衡:插入阳离子后向金属表面注入等量电子维持系统电中性。
4.3动力学模拟参数AIMD设置系综:正则系综(NVT)。 温度控制:Nose-Hoover恒温器(298K)。 时间步长:1.0fs。 截断能:400eV(平面波基组)。 k点取样:仅Γ点(无对称性约束)。 轨迹长度:>10ps(前4ps平衡,后6–9ps统计分析)。
慢增长法(Slow-growth)参数应用场景:模拟Hₐd脱附过程(Hₐd+H₂O→H₃O⁺+e⁻)。 集体变量(CV):Hₐd与水分子的O原子距离。 增量速度:0.0008Å/fs(经收敛验证,图S25)。 自由能校正:采用Chan-Nørskov方法处理恒电位条件。
4.4关键物理量计算电极电位计算公式:URHE=(Φ−ΦSHE)/e+0.059×pH Φ(功函数):真空能级(E_vac)与费米能级(E_F)之差。 E_vac确定:界面电子密度衰减至10⁻⁵e⁻·Å⁻³时的平面平均静电势(Computationalmethods)。 Φ_SHE:标准氢电极功函数(4.44V)。
零电荷电位(PZC)验证计算PZC与实验值(Gouy-Chapman电容法)对比(表S1),误差<0.1V:
4.5模拟验证与收敛性结构收敛测试水分子取向分布(图S6)和阳离子配位距离(图S30)统计超过6ps轨迹,确保采样充分。
慢增长法验证对比增量速度0.0008Å/fs与0.0004Å/fs,自由能剖面一致(图S25)。
实验关联模拟界面水结构与原位SEIRAS光谱匹配(,Figure4)。 阳离子特异性趋势(K⁺>Na⁺>Li⁺)被电化学测试证实(,Figure6a)。
4.6计算参数总结表
此计算框架为理解界面溶剂化结构与HOR动力学的阳离子效应提供了原子尺度基础,且所有参数均通过收敛性测试和实验验证。 |